サイエンス


mRNA医薬について
mRNAとは
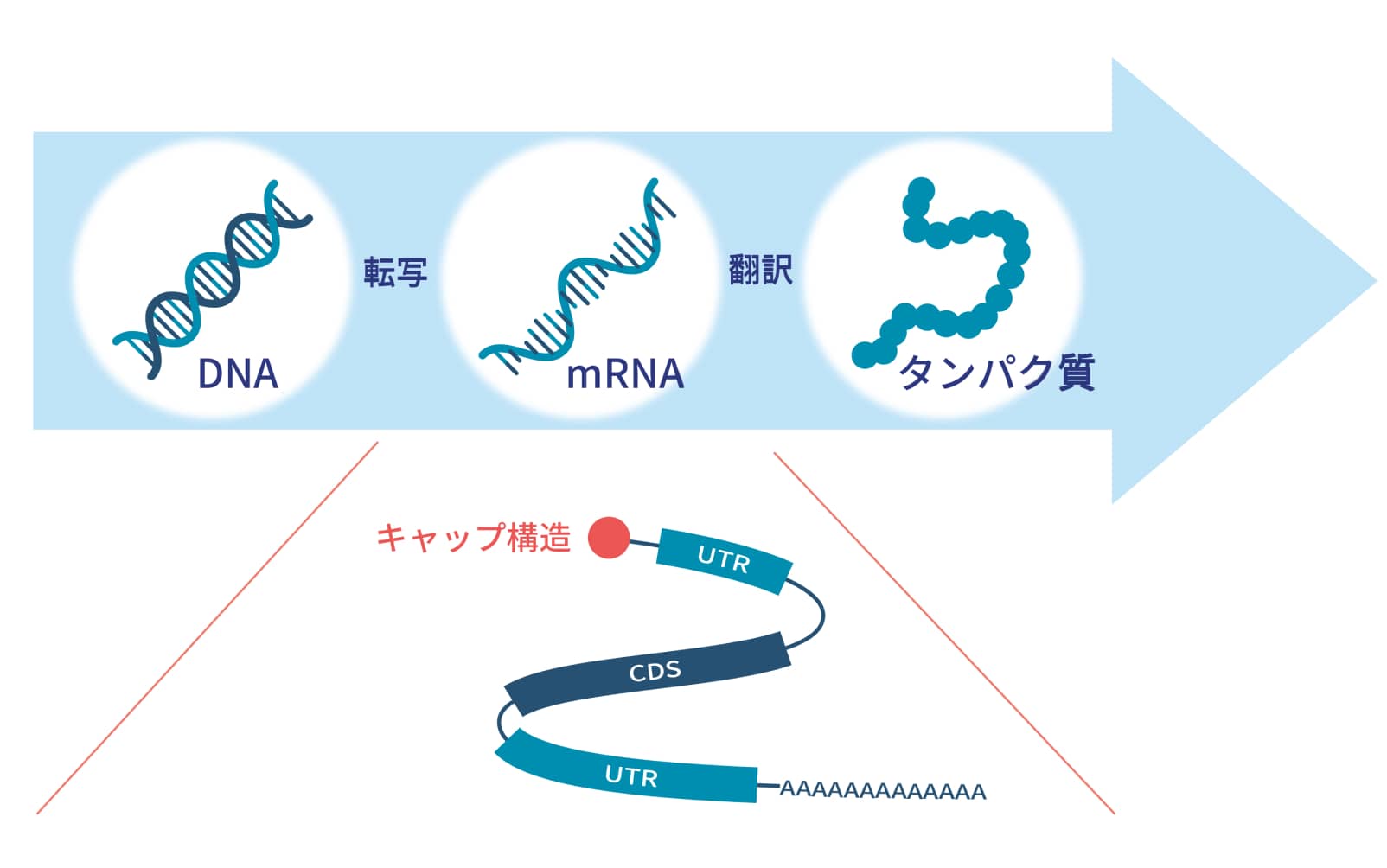
私たちの体の中では、遺伝情報を持つDNAからタンパク質の設計図であるメッセンジャーRNA (
mRNAは主に4つの部分から構成されています。
キャップ構造:mRNAであるという目印になる構造
UTR:非翻訳領域 翻訳されないがmRNAの安定性や翻訳効率に関与
CDS:翻訳領域 実際にタンパク質の情報が書かれている部分
ポリA鎖:mRNAの安定性や翻訳効率に関与
これらのうち、キャップ構造はmRNAの翻訳を開始するのに重要な構造です。この構造がない場合、mRNAとして認識されず翻訳が進行しません。
遺伝子治療とmRNA医薬品
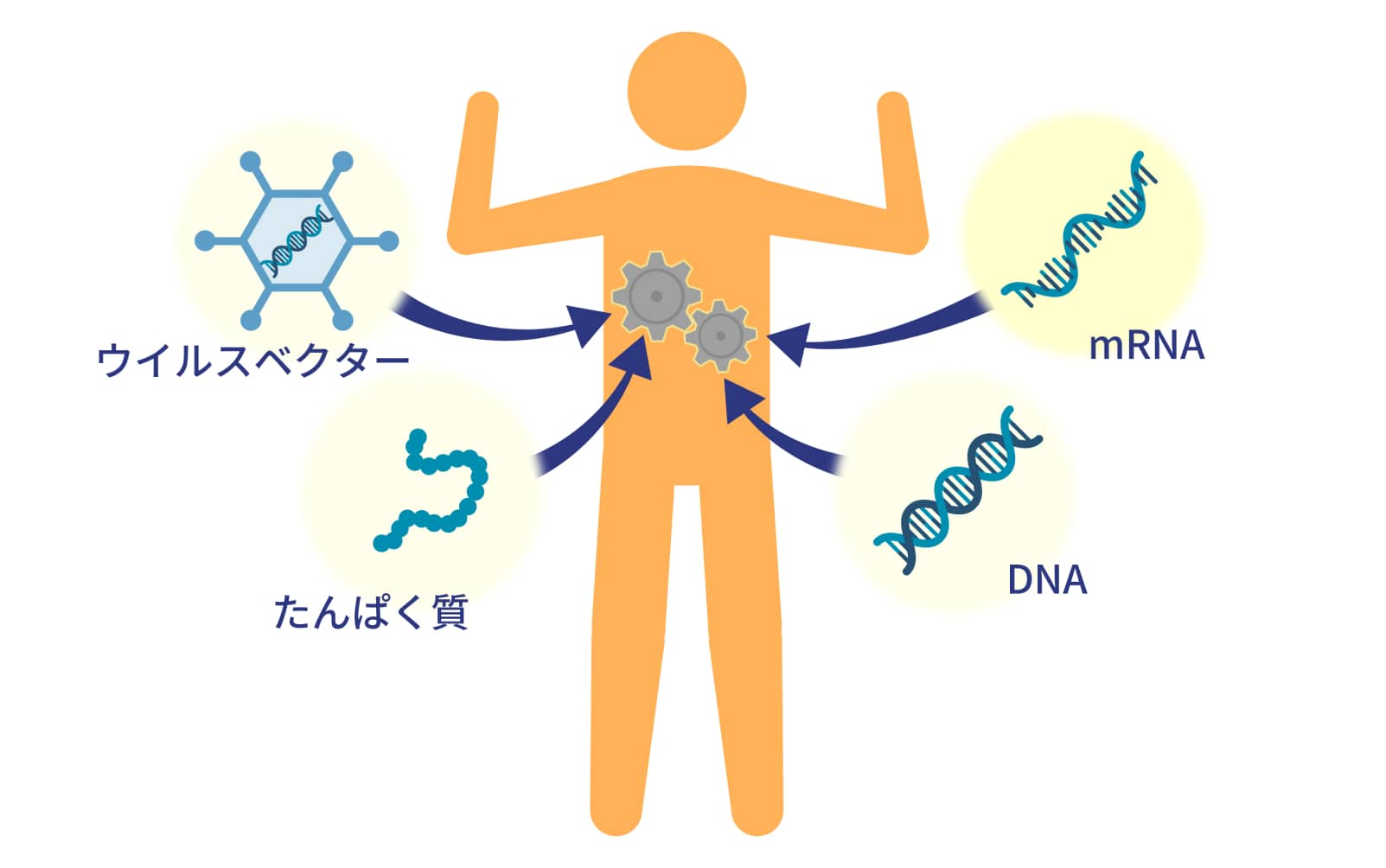
近年、遺伝子工学の発展に伴って遺伝的な疾患を根本から治療する遺伝子治療が台頭してきました。遺伝子治療は、外から遺伝子を導入することで治療効果を発揮します。特に、特定のたんぱく質が不足する疾患に対し、そのたんぱく質の遺伝情報もしくはそのたんぱく質自体を投与して症状を緩和する「たんぱく質補充療法」に期待が高まっています。
遺伝子を導入する方法として、たんぱく質を直接導入したり、ウイルスベクターを用いてDNAを導入する方法が開発されてきました。一方、mRNAは安定性の低さや免疫刺激性の高さから、遺伝子治療への利用は困難だとされてきました。しかし、カリコ氏らの研究によりmRNAを治療薬として用いる方法が確立され、新たな形の遺伝子治療薬として期待されています。mRNA医薬品は他と比較して、開発スピードが速く、遺伝子挿入のリスクが低いため安全であり、有効性の高い医薬品です。

PureCapについて
mRNA医薬の現状
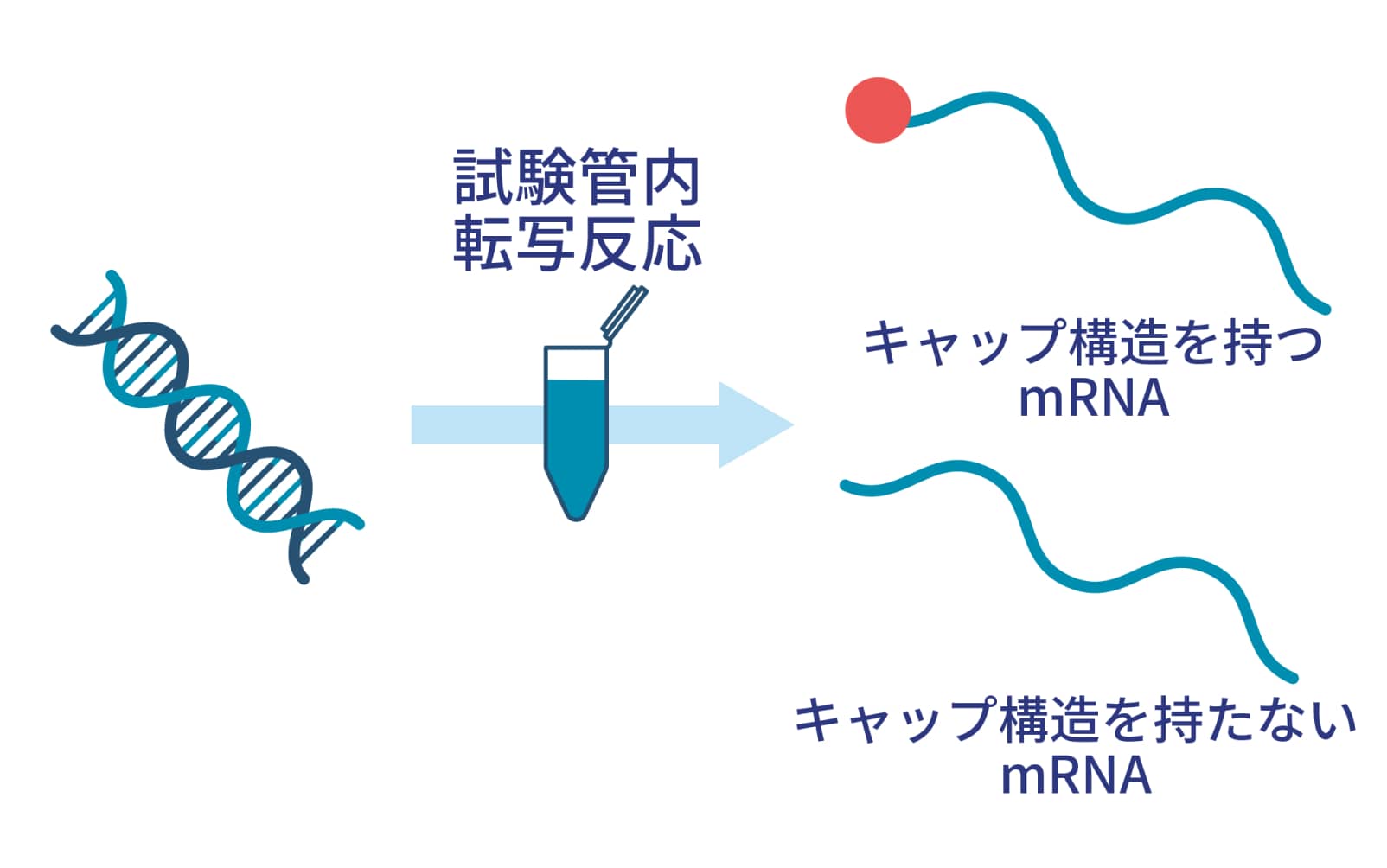
mRNA医薬は、酵素を用いた試験管内での転写反応により調製されます。この方法ではキャップ構造を持つ目的のmRNAと、キャップ構造を持たないmRNAの混合物が得られます。これらは分離が困難ですが、キャップ構造を持たないmRNAは免疫刺激性が高く、医薬品として用いる場合には過剰な副反応を引き起こすおそれがあります。そのため、キャップ構造を持つmRNAだけをきれいに単離する技術が必要とされています。
PureCapアナログの開発
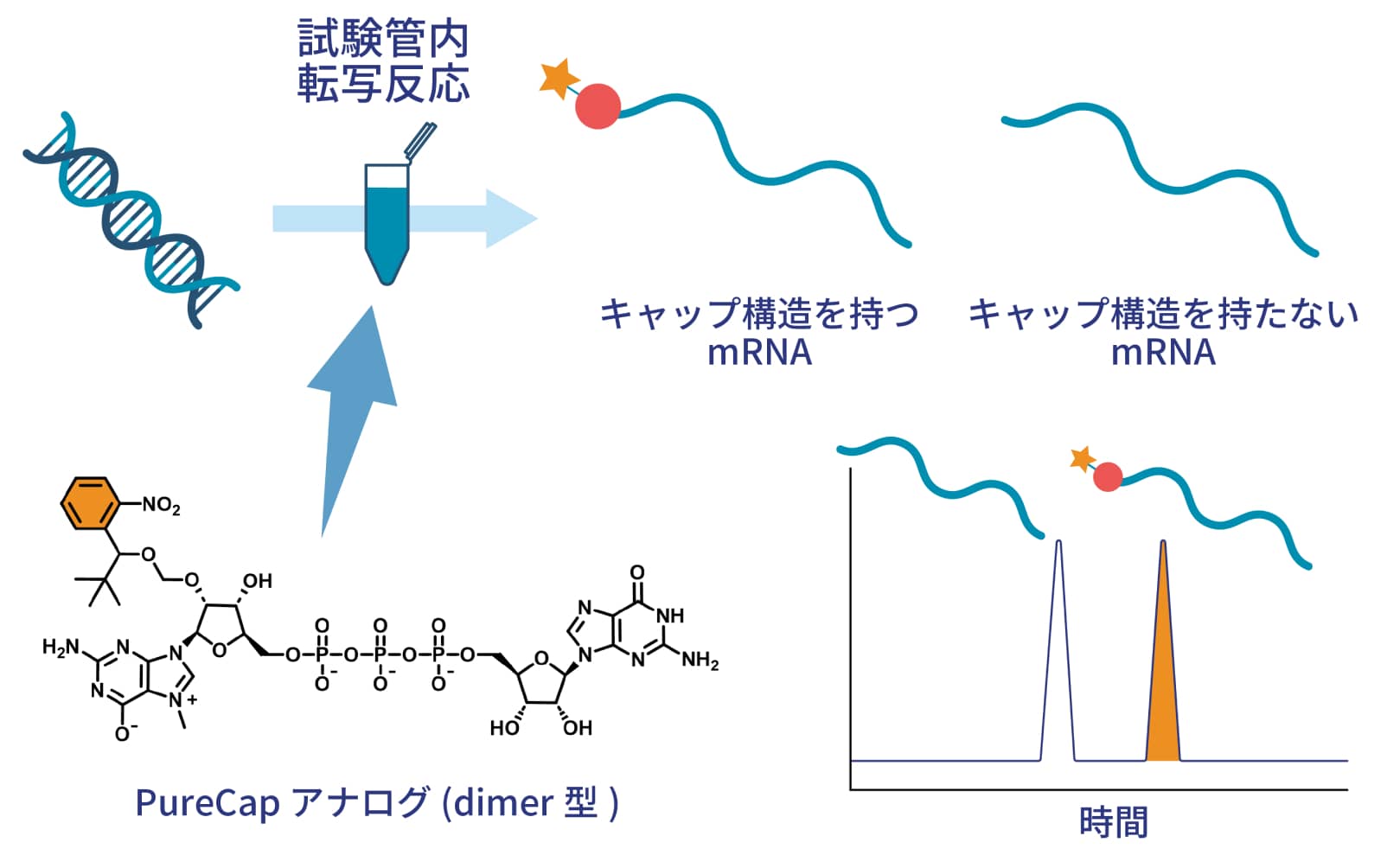
私たちは上記の課題を解決すべく、「PureCapアナログ」というキャップ化試薬を開発しました。通常の共転写反応で用いるキャップ化試薬をPureCapアナログに置き換えるだけで、高純度のmRNAを簡単に調製することができます。
PureCapアナログには精製用の疎水性タグが付いているため、HPLC上でキャップ化mRNAとキャップ構造を持たないmRNAを簡単に分離することができます。さら、疎水性タグは温和な条件で除去でき、精製後にタグを除去することで天然型のmRNAを得ることができます。
PureCapアナログの有効性
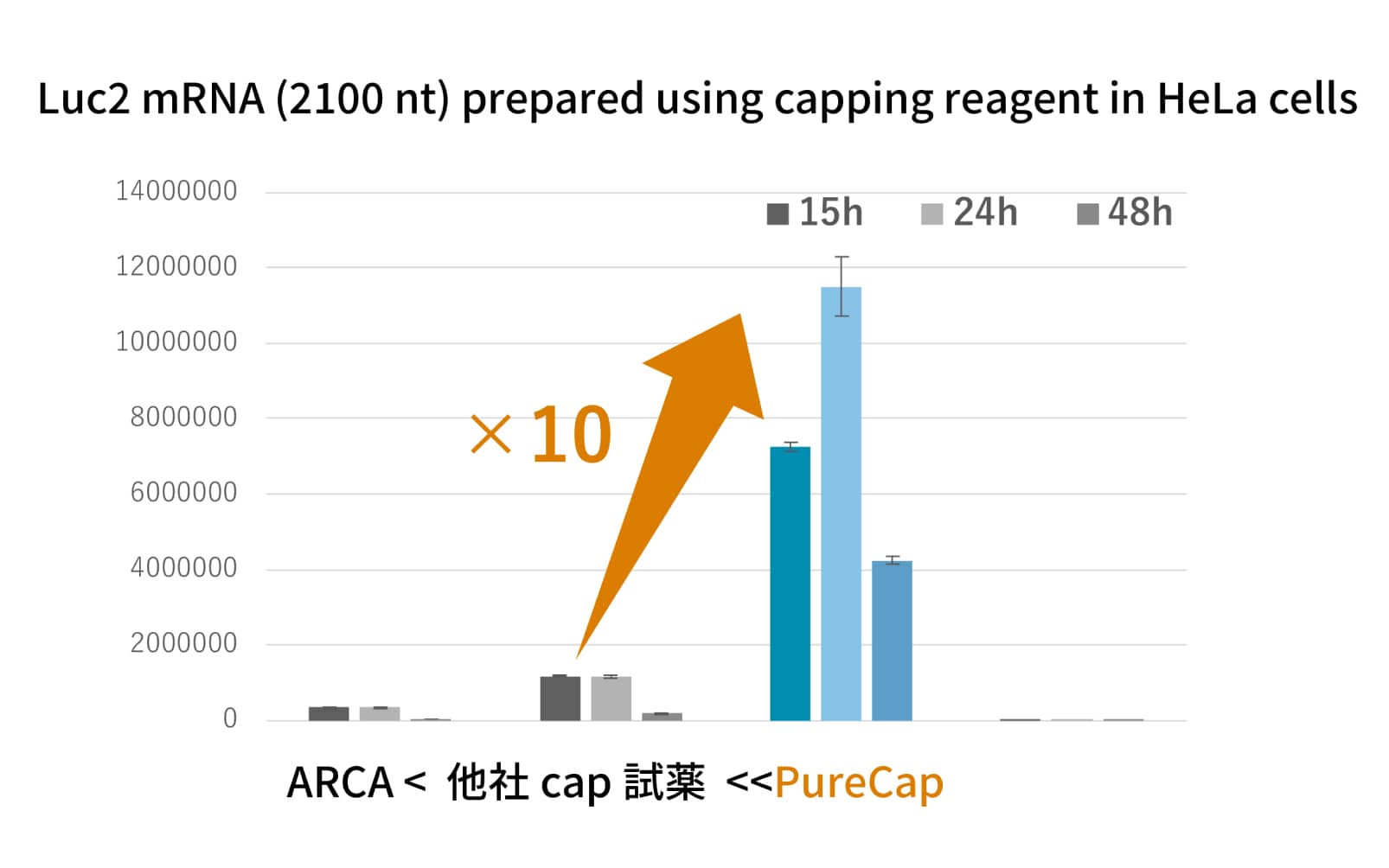
PureCapアナログを用いて調製したmRNAは、高純度で免疫原性が低いことが特徴です。また、純度が高いため少量で十分な薬効を発揮できます。そのため、投与量を減らすことができ、体への負担軽減やコスト削減が期待できます。

参考文献
- T. A. Tockary, et al., Comb-structured mRNA vaccine tethered with short double-stranded RNA adjuvants maximizes cellular immunity for cancer treatment. PNAS, 2023, 120, e2214320120.
- S. Abbasi, et al., Co-encapsulation of Cas9 mRNA and guide RNA in polyplex micelles enables genome editing in mouse brain. J. Controlled Release, 2021, 332, 260-268.
- N. Yoshinaga, et al., Bundling mRNA Strands to Prepare Nano-Assemblies with Enhanced Stability Towards RNase for In Vivo Delivery. Angew. Chem. Int. Ed., 2019, 58, 11360-11363.
- N. Yoshinaga, et al., Induced packaging of mRNA into polyplex micelles by regulated hybridization with a small number of cholesteryl RNA oligonucleotides directed enhanced in vivo transfection. Biomaterials, 2019, 197, 255-267.
- S. Uchida, et al., Designing immunostimulatory double stranded messenger RNA with maintained translational activity through hybridization with poly A sequences for effective vaccination. Biomaterials, 2018, 150, 162-170.
- S. Uchida, et al., Systemic delivery of messenger RNA for the treatment of pancreatic cancer using polyplex nanomicelles with a cholesterol moiety. Biomaterials, 2016, 82, 221-228.
- S. Uchida, et al., In vivo messenger RNA introduction into the central nervous system using polyplex nanomicelle. PLOS ONE, 2013, 8, e56220.
- R. A. Husseini, et al., Use of Iontophoresis Technology for Transdermal Delivery of a Minimal mRNA Vaccine as a Potential Melanoma Therapeutic. Biol. Pharm. Bull., 2023, 46, 301-308.
- M. Inagaki, et al., Cap analogs with a hydrophobic photocleavable tag enable facile purification of fully capped mRNA with various cap structures. Nat. Commun., 2023, 14, 2657.
- D. Kawaguchi, et al., Phosphorothioate Modification of mRNA Accelerates the Rate of Translation Initiation to Provide More Efficient Protein Synthesis. Angew. Chem. Int. Ed., 2020, 59, 17403-17407.
- N. Abe, et al., Complete Chemical Synthesis of Minimal Messenger RNA by Efficient Chemical Capping Reaction. ACS Chem. Biol., 2022, 17, 1308-1314.

